Les 7 types d’étoiles (et leurs caractéristiques)
26 mai 2021ce que c’est, les fonctionnalités et comment le faire
26 mai 2021Selon l’Étude mondiale du fardeau des maladies, 95% de la population mondiale a un problème de santé, du moins dans le groupe échantillon analysé entre 1990 et 2013. Ce n’est pas surprenant, puisque 15% de la biomasse Le monde sous la forme du carbone est constitué de bactéries (70 gigatonnes), certaines d’entre elles bénéfiques pour l’homme, d’autres commensaux et d’autres directement pathogènes.
Au-delà des bactéries, il existe des milliers d’agents infectieux non vivants sous forme de virus, qui mutent à un rythme effréné et évoluent pour contourner l’immunité à long terme des organismes. La compétition des humains avec les pathogènes est une véritable course aux armements: lorsqu’une réponse spécifique à un pathogène se développe, on s’attend à ce qu’il finisse par muter pour ne plus être reconnu par les lymphocytes et d’autres organismes spécifiques.
Pour cette raison, les campagnes de vaccination contre la grippe sont annuelles, tandis que d’autres vaccins offrent une immunité à vie contre un agent pathogène donné. Selon le taux de mutation et l’adaptabilité de l’organisme, les risques d’infection peuvent augmenter ou diminuer avec le temps. Sur la base de ces prémisses intéressantes, nous vous disons tout ce que vous devez savoir immunoglobulines.
Que sont les immunoglobulines?
Selon le National Cancer Institute (NIH), une immunoglobuline ou un anticorps est une protéine fabriquée par des plasmocytes (types de globules blancs) en réponse à la présence d’un antigène, une substance qui provoque l’activation du système immunitaire humain, lorsqu’elle est reconnue comme une menace. La clé pour comprendre l’immunité est basée sur la dyade anticorps (Ig) – antigène (Ag) ou ce qui est identique, Ig-Ag.
Chaque immunoglobuline se lie à un seul antigène, ce qui permet aux cellules immunitaires de destruction spécialisées (telles que les macrophages) de reconnaître et d’engloutir plus efficacement le pathogène, mais certains d’entre eux peuvent également détruire l’antigène directement. Chaque anticorps a un paratope ou un site de liaison à l’antigène spécialisé, qui est spécifique de l’épitope de l’antigène lui-même. En d’autres termes, chaque complexe Ig-Ag implique une serrure et une clé non transférables.
L’utilité la plus évidente des immunoglobulines dans la société en général est, sans aucun doute, le développement de vaccins. Lorsqu’un virus ou une bactérie affaiblie est introduit dans le corps (ou une section de celui-ci qui favorise une réponse immunitaire), la prolifération des lymphocytes et la libération d’immunoglobulines spécifiques pour cet antigène sont stimulées. A) Oui, le corps « apprend » quel est le microorganisme dangereux, toujours grâce à la sécurité d’une inactivation pathogène antérieure.
Grâce à ce mécanisme de vaccination sûr, on estime que plus de 37 millions de vies ont été sauvées dans le monde au cours des 20 dernières années, en particulier chez les enfants. Un exemple clair de ceci est la variole: au 18ème siècle, 400 000 personnes mouraient chaque année de cette maladie, ce qui se traduisait par un taux de mortalité de l’agent de près de 30%. Grâce à la vaccination, le dernier cas de variole a été diagnostiqué en 1977 et l’OMS a déclaré le monde indemne de l’agent pathogène dans les années 1980. Sans aucun doute, la connaissance des immunoglobulines nous a permis de nous libérer en tant qu’espèce de ravages épidémiologiques.
Structure de ces protéines
Les immunoglobulines ont une forme typique en «Y», composée de deux moitiés différentes.. Vous devez imaginer clairement cette conformation dans votre esprit avant de continuer, car nous allons nous baser sur ce modèle pour décrire la conformation générale des anticorps.
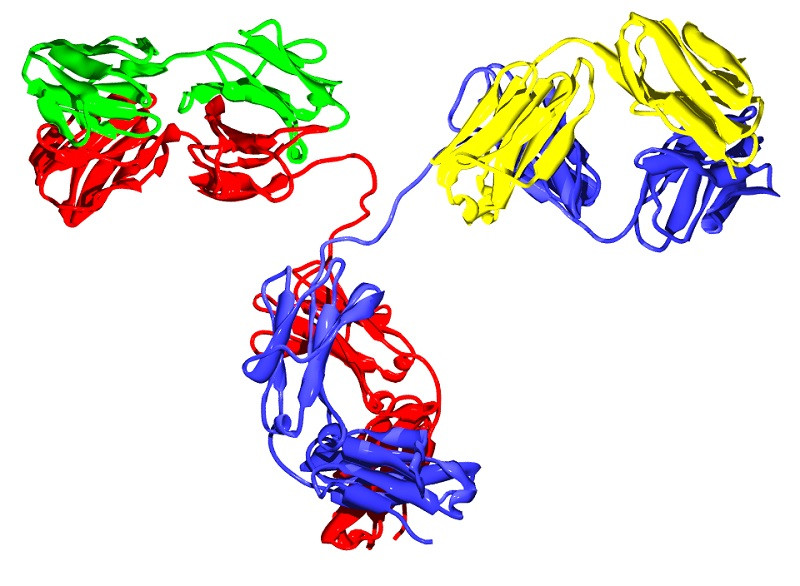
Comme toutes les protéines, une immunoglobuline a l’acide aminé comme unité de base, chacune des sous-unités qui, reliées par des liaisons peptidiques, donnent naissance à des peptides (moins de 10 acides aminés), des polypeptides (plus de 10) et des protéines (de nombreux acides aminés concaténés). Dans ce cas, l’immunoglobuline standard est composée de 4 unités polypeptidiques: deux chaînes lourdes égales (lourdes, à la base et clivage du «Y») et 2 chaînes légères identiques (légères, chacune des extrémités latérales des branches du «Y»).
Chaque région «H» est composée d’une région variable (VH) et de 3-4 régions constantes (CH1, CH2, CH3, etc.). D’autre part, les chaînes légères « L » sont constituées d’une région variable (VL) et d’une région constante (CL). Todo esto puede sonar muy lioso, pero solo hace falta quedarse con el siguiente concepto: las puntas de las cadenas pesadas (H) y ligeras (L) son variables, mientras que la conformación en general de “Y” es constante entre inmunoglobulinas del mismo Type.
La forme en «Y» est celle qui est typique des cours de biologie et d’immunologie, mais pas la seule. Cette forme monomère englobe les immunoglobulines D, E et G, tandis que l’Ig A est un dimère et l’Ig M est un pentamère. Comme vous pouvez l’imaginer ces changements anatomiques impliquent également une nette variabilité de la fonctionnalité.
Les types d’immunoglobulines
Nous quittons la forêt moléculaire pour revenir à des thèmes un peu plus généraux, cette fois, les différentes fonctions des immunoglobulines en fonction de leur désignation. Nous les décrivons brièvement.
1. Immunoglobuline A
On le trouve dans les muqueuses des voies respiratoires, du tractus urogénital et de la lumière du système digestif, en plus de la salive, des larmes et du lait maternel. Fait intéressant, dans le sang, il se trouve sous une forme monomère (comme le « Y » décrit ci-dessus), mais dans la muqueuse, sa disposition est dimère.
En raison de leur proximité avec les seuls systèmes ouverts du corps humain (excréteur, respiratoire et digestif), ces immunoglobulines sont les premiers à entrer en contact avec des virus qui envahissent la cavité oropharyngée et d’autres microorganismes intestinaux.
2. Immunoglobuline G
Cette immunoglobuline est celle qui est la plus représentée dans le sang, le liquide céphalo-rachidien et le liquide péritonéal (de la cavité abdominale). Constitue 80% des immunoglobulines totales, c’est donc sans aucun doute le plus important.
De plus, il est à noter qu’il existe 4 sous-variantes de ce type d’immunoglobuline, de l’IgG 1 à l’IgG4. Chacun d’eux est particulièrement compétent sur un front spécifique, détectant les antigènes et les toxines de différents micro-organismes.
3. Immunoglobuline M
Il s’exprime à la surface des lymphocytes B, principaux effecteurs de la réponse humorale du système immunitaire adaptatif.
Ils sont la réponse d’urgence à une infection, car ils éliminent les agents pathogènes à un stade précoce jusqu’à ce que le système immunitaire synthétise suffisamment de type IgG. Ils représentent 6% des immunoglobulines circulantes dans le sang humain et sont présents dans la grande majorité des animaux, ils sont donc considérés comme les anticorps les plus anciens de l’histoire de l’évolution chez les vertébrés.
4. Immunoglobuline E
L’anticorps cliniquement lié aux conditions allergiques. Normalement, cette immunoglobuline se trouve en petites quantités circulant dans le sang, mais augmente considérablement lorsque le corps est exposé à un allergène, ou ce qui est pareil, une substance inoffensive qui provoque une réaction injustifiée dans le système immunitaire de l’individu. Il est également exprimé en quantités atypiques dans les infections parasitaires.
5. Immunoglobuline D
C’est l’une des immunoglobulines les moins exprimées, mais ce n’est pas moins important pour cela. Il ne représente que 1% des immunoglobulines totales de l’organisme et c’est le composant le plus important de la surface de nombreux lymphocytes de type B au stade de leur maturation. En raison de sa rareté, sa fonction est moins définie que celle du reste des variantes déjà décrites.
résumé
Comme vous l’avez peut-être vu, les immunoglobulines se présentent sous diverses formes (isotypes) et arrangements morphologiques, mais elles ont toutes une fonction très claire: protéger l’organisme contre d’éventuelles infections et agents pathogènes. Des virus aux parasites morphologiquement plus complexes (comme les helminthes), les immunoglobulines sont capables de les reconnaître, d’activer d’autres cellules immunitaires, de les marquer en fonction de leurs antigènes de surface et, après la réaction en cascade correspondante, de les éliminer.
En résumé, les immunoglobulines sont des protéines sécrétées par les lymphocytes B et les plasmocytes en réponse à un antigène qui s’est infiltré dans le corps de l’hôte. Des réponses immunitaires aux réactions allergiques, les anticorps ont une variété de fonctions protectrices.
Références bibliographiques:
- Álvarez, N., Otero, O., Falero, G., Cádiz, A., Marcet, R., Carbonell, AE, … et Acosta, A. (2010). Purification de l’immunoglobuline A sécrétoire du colostrum humain. Vaccimonitor, 19 (3), 26-29.
- Burton, DR (1985). Immunoglobuline G: sites fonctionnels. Immunologie moléculaire, 22 (3), 161-206.
- Heremans, JF (1974). Immunoglobuline A. Dans les antigènes (pp. 365-522). Presse académique.
- Jiménez, ALC, Cataño, AO, Rincón, JCA et Delgado, CMM (2013). Action de l’immunoglobuline A sécrétoire dans le processus d’adhésion de Streptococcus mutans à la dent humaine. Journal de dentisterie, 26 (2), 76-106.
- Lefranc, MP et Lefranc, G. (2001). Le cahier d’information sur les immunoglobulines. Presse académique.
- Orbach, H., Katz, U., Sherer, Y., et Shoenfeld, Y. (2005). Immunoglobuline intraveineuse. Revues cliniques en allergie et immunologie, 29 (3), 173-184.
- Rojas-Torres, DS, Bastidas-Yaguana, DK, Sierra-Santos, L., et Aguilar-Shea, AL (2014). Importance du déficit sélectif de l’immunoglobuline A. SEMERGEN-Medicina de Familia, 40 (3), e65-e68.
- Woof, JM et Kerr, MA (2006). La fonction de l’immunoglobuline A dans l’immunité. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 208 (2), 270-282.
