Comment surmonter les pensées négatives au quotidien
25 mai 2021qu’est-ce que c’est, caractéristiques et comment fonctionne cette protéine
25 mai 2021L’être humain et le reste des animaux sont des systèmes ouverts, car nous avons besoin de l’ingestion de matière organique pour obtenir de l’énergie. 50% de notre alimentation est composée de glucides, 30% de matières grasses et 10 à 15% de protéines.
Tous ces macronutriments sont décomposés par hydrolyse en petites biomolécules, qui traversent la membrane plasmique des cellules et s’oxydent dans l’environnement mitochondrial, afin d’obtenir de l’énergie pour tous les tissus et réactions nécessaires à la vie.
La digestion, connue sous le nom de processus par lequel un aliment est transformé dans le système digestif en une substance que le corps assimile, est essentielle pour que l’aliment finisse par être converti en énergie et en chaleur métabolique. Pour cela, les aliments sont ingérés par la bouche, soumis à une série de changements mécaniques et chimiques, transportés vers l’estomac, puis vers les intestins et, enfin, les déchets sont éjectés dans l’environnement sous forme de matières fécales.
Ce processus général décrit le passage des aliments à travers le système digestif de manière extrêmement brève, mais il convient de noter que chacune de ces sections du système est caractérisée par une série de réactions chimiques et physiques d’un grand intérêt. Aujourd’hui, nous vous disons tout sur la pepsine, une de ces enzymes essentielles pour comprendre la digestion au niveau gastrique.
Qu’est-ce que la pepsine?
Tout d’abord, il convient de noter que la pepsine est une endopeptidase, c’est-à-dire une enzyme qui décompose les protéines obtenues lors de l’apport alimentaire en peptides plus petits. Ces types de molécules enzymatiques rompent les liaisons peptidiques entre les acides aminés au sein de la chaîne protéique, en suivant une série de directives très spécifiques. La pepsine n’est pas la seule endopeptidase en charge de la digestion, puisque la trypsine, la chymotrypsine, l’élastase ou la thermolysine, entre autres, se distinguent également dans ce groupe.
Malgré la variété des endopeptidases dans l’environnement gastrique, la pepsine est considérée comme l’une des plus importantes, avec la trypsine et la chymotrypsine.. De plus, son environnement d’action est très clair et délimité: il fonctionne au mieux entre un pH de 1,5 et 2, les conditions idéales exactes de l’estomac. Une fois qu’elle atteint la partie du duodénum (avec un pH de 6), cette enzyme est inactivée et sa fonctionnalité prend fin (bien qu’elle conserve sa conformation tridimensionnelle jusqu’à un pH de 8).
Dans tous les cas, il est nécessaire de préciser que la digestion des protéines se poursuit également au niveau intestinal, en raison des effets des enzymes pancréatiques telles que la trypsine, la chymotrypsine, l’élastase et la carboxypeptidase. Ainsi, malgré son caractère essentiel, la pepsine n’est pas indispensable à la vie: si cette enzyme fait défaut, d’autres peuvent prendre en charge le métabolisme des protéines, avec plus ou moins d’effort.
Avec curiosité, l’activité enzymatique de la pepsine et d’autres enzymes pourrait auto-dégrader les propres tissus de l’organisme s’il n’y avait pas de mécanismes préventifs clair et efficace. Heureusement, la barrière muqueuse de l’estomac sécrète une substance de type mucus-bicarbonate, qui donne à la paroi gastrique un environnement de pH presque neutre et inactive la pepsine. L’estomac lui-même doit se protéger de l’activité enzymatique qui s’y déroule, aussi contre-intuitive que cela puisse paraître.
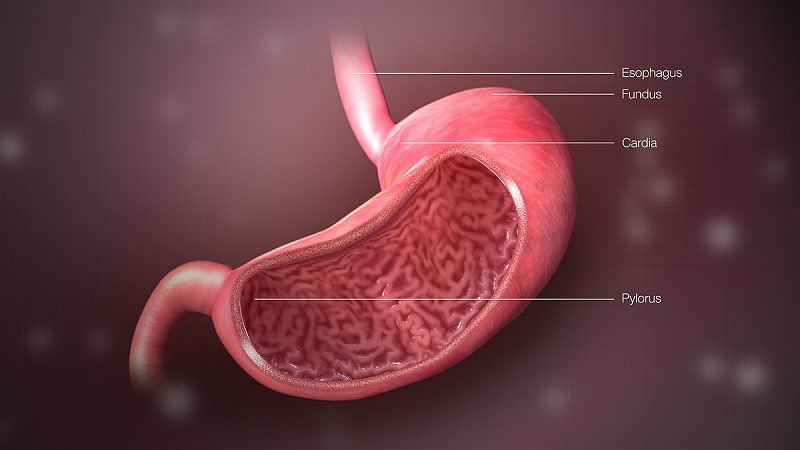
La synthèse de la pepsine
La pepsine est synthétisée dans l’estomac, comme nous l’avons laissé entendre dans les lignes précédentes. De toute façon, les cellules de l’estomac (principales cellules des glandes gastriques) ne sécrètent pas la pepsine elle-même, mais le pepsinogène. Ce composé est un zymogène ou proenzyme inactif, contenant 44 acides aminés « supplémentaires », par rapport à l’enzyme réelle.
L’hormone gastrine, sécrétée par les cellules G de l’appareil gastrique, stimule la sécrétion de pepsinogène et d’acide chlorhydrique, ce qui génère un environnement de pH très acide dans la chambre de l’estomac. Lorsque le pepsinogène entre en contact avec ce conglomérat acide, il subit une réaction autocatalytique, dans laquelle il est libéré de la «queue» d’acides aminés qui le maintenait inactif. Ainsi, grâce à la présence d’acides gastriques, le pepsinogène est transformé en sa variante active de la pepsine et cela peut commencer à décomposer les protéines en molécules plus petites.
En outre, il est nécessaire de souligner que le pepsinogène est synthétisé grâce aux instructions présentes dans les gènes, c’est-à-dire, les chromosomes dans les cellules. Chez l’homme, il existe 3 gènes différents qui codent pour la même forme de pepsinogène A: PGA3, PGA4 et PGA5. Tous ont les directions de la synthèse du zymogène, qui est ensuite transformé en enzyme par la stimulation des acides gastriques.
D’un autre côté, certains composés (comme la pepstatine) sont capables d’inhiber la pepsine à de très faibles concentrations. La pepstatine a été isolée pour la première fois dans des cultures de champignons actinomycètes, mais on en sait peu sur elle au-delà de son activité en tant que protéase.
Fonction pepsine
À ce stade, il est essentiel de souligner que La pepsine est dédiée à la dégradation des protéines, mais étant composée d’acides aminés, cette enzyme est également une protéine en soi. Les acides aminés sont l’unité de base de toute protéine, car ils sont joints dans des ordres spécifiques par des liaisons peptidiques pour donner naissance à des peptides (moins de 10 acides aminés), des polypeptides (10 à 50 acides aminés) et des protéines (plus de 50 acides aminés) .
De son côté, la pepsine «coupe» la chaîne protéique à dégrader au niveau des acides aminés leucine (leu) phénylalanine (phe), tryptophane (trp) ou tyrosine (tyr), sauf si l’un d’eux est précédé de la proline (pro). On se souvient qu’il s’agit d’une endopeptidase, ce qui signifie qu’elle coupe « à l’intérieur » (entre les acides aminés qui ne font pas partie de la section protéique terminale).
Les protéines ne représentent que 10 à 15% de notre alimentation (les glucides étant la source d’énergie la plus riche), mais elles représentent 50% du poids sec de presque tous les tissus biologiques, car il n’y a pas de processus métabolique qui ne dépende pas d’un façon d’eux. C’est pourquoi la pepsine et le reste des enzymes qui dégradent les protéines sont si essentiels: non seulement pour obtenir de l’énergie, mais pour l’intégration d’acides aminés dans les tissus biologiques, tels que les muscles et la peau.
Le rôle de la pepsine dans les pathologies
Comme tout élément du corps humain, la pepsine peut échouer ou effectuer des activités à des moments où cela n’est pas nécessaire, ce qui conduit à des pathologies. Dans ce cas, cette enzyme et d’autres jouent un rôle essentiel dans le développement de symptômes de reflux laryngopharyngé (LPR) et de reflux gastro-œsophagien (RGO).
Une personne dont le sphincter œsophagien inférieur (SOI) est affaibli peut éprouver ces conditions, car le bol alimentaire mélangé avec des sucs gastriques remonte dans l’œsophage si l’environnement de l’estomac n’est pas bien défini. Cela provoque le retour des acides, de la pepsine et d’autres enzymes dans le tube œsophagien, atteignant même le larynx et, dans le pire des cas, l’environnement pulmonaire.
Pour compliquer davantage les choses, les patients LPR ont altéré la sensibilité neurale locale, de sorte qu’ils ne peuvent pas répondre par la toux et les râles à la présence d’acide dans l’environnement laryngé. Etre sous sa forme active et ne pas être excrété, la pepsine commence à décomposer les tissus du larynx, entraînant une dysphagie chronique (incapacité à avaler), une voix dure et des toux répétées. Plus la pepsine est en contact avec l’environnement laryngé, plus les dommages sont graves.
résumé
Comme vous l’avez peut-être vu, la pepsine est une enzyme très intéressante au niveau physiologique, car elle s’auto-active avec l’environnement acide de l’estomac et sa fonctionnalité est régulée complètement en fonction du pH environnemental. Si le pH est maintenu entre 1,5 et 2, l’enzyme reste sous sa forme active et fait son travail. Lorsque cette valeur change, il conserve sa conformation tridimensionnelle, mais ne décompose pas les protéines comme il le fait à l’intérieur de l’estomac.
Grâce à la pepsine et à de nombreuses autres biomolécules à caractère enzymatique, l’être humain peut transformer les protéines que nous consommons en énergie et surtout en acides aminés utiles à la formation et à la réparation des tissus. Bien sûr, il est clair pour nous que sans notre métabolisme interne, nous ne sommes rien.
Références bibliographiques:
- Umezawa, H., AOYAGI, T., MORISHIMA, H., MATSUZAKI, M., HAMADA, M., et TAKEUCHI, T. (1970). Pepstatin, un nouvel inhibiteur de la pepsine produit par les agtinomygètes. Le Journal des antibiotiques, 23 (5), 259-262.
- Rajagopalan, TG, Moore, S. et Stein, WH (1966). Pepsine de pepsinogène: Préparation et propriétés. Journal of Biological Chemistry, 241 (21), 4940-4950.
- Ly, J., Almaguel, R., Delgado, E., Carón, M., et Cruz, E. (2010). Etudes de digestibilité in vitro (pepsine / pancréatine) des racines de manioc pour nourrir les porcs ». Journal informatisé du volume de production porcine, 17 (4).
- Heda, R. et Tombazzi, CR (2018). Physiologie, pepsine. StatPearls [Internet].
- Brown, J., et Shermetaro, C. (2021). Reflux laryngopharyngé. StatPearls [Internet].
- Bernal, JD et Crowfoot, D. (1934). Photographies aux rayons X de la pepsine cristalline. Nature, 133 (3369), 794-795.
- Bajwa, SA, Toro, F., et Kasi, A. (2020). Physiologie, œsophage. StatPearls [Internet].
- Akeson, WR et Stahmann, MA (1964). Un indice de digestion de la pancréatine par la pepsine d’évaluation de la qualité des protéines. Le Journal de la nutrition, 83 (3), 257-261.
